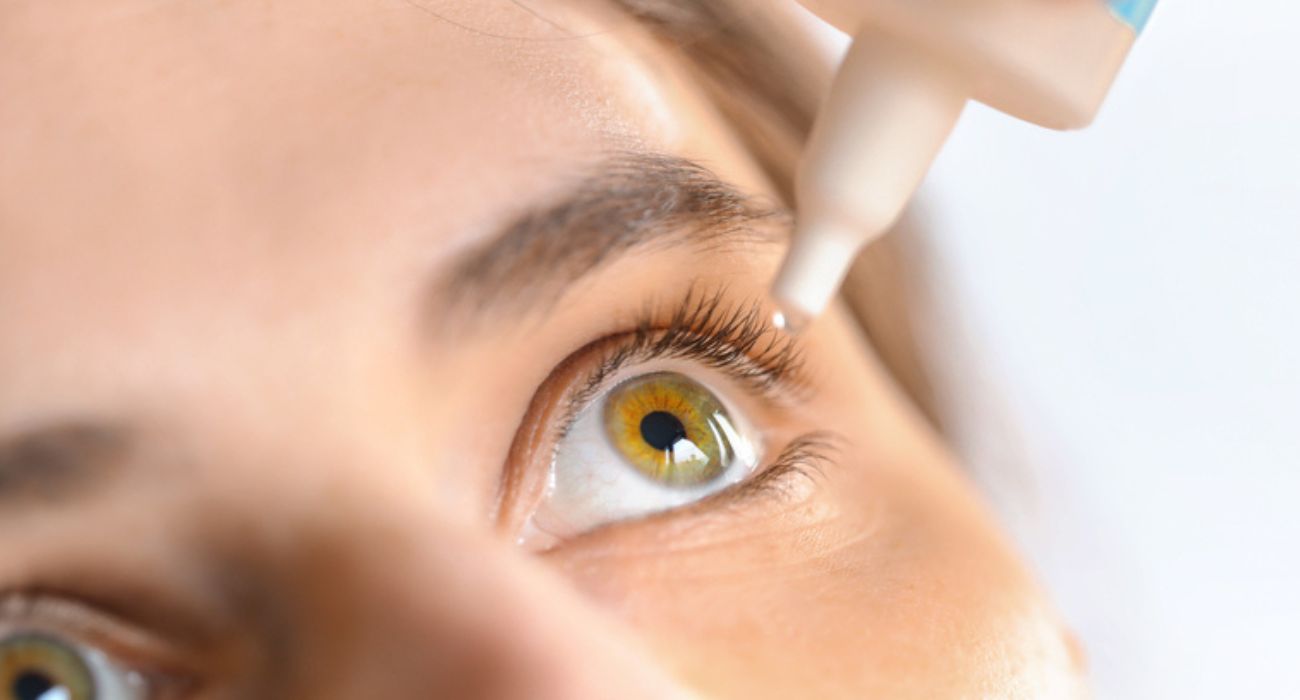
Los funcionarios de salud buscan garantizar la seguridad de las gotas para los ojos después de meses de numerosos retiros del mercado, pero esto requerirá nuevos poderes de la FDA.
La FDA está solicitando al Congreso nuevas capacidades de supervisión, como exigir a los fabricantes extranjeros que se sometan a inspecciones antes de enviar sus productos y autoridad obligatoria para retirar medicamentos. reportaron AP.
"La FDA no está haciendo su trabajo en términos de inspecciones de control de calidad de los medicamentos en el extranjero", dijo David Ridley de la Universidad de Duke, según AP. "Muy pocos fabricantes de medicamentos extranjeros han sido inspeccionados en los últimos cuatro años".
Ridley es coautor de un nuevo estudio publicado este mes que encontró que las inspecciones globales de medicamentos por parte de la FDA han estado disminuyendo desde la pandemia de COVID-19, y señaló que las inspecciones extranjeras habían estado aumentando antes de su inicio.
“Después del inicio de la pandemia de COVID-19 y la publicación de las directrices industriales revisadas de la FDA, el número de inspecciones disminuyó significativamente y no se había recuperado a partir de 2022, especialmente para los establecimientos extranjeros”, dice el estudio. "En 2022, el total de inspecciones extranjeras anuales disminuyó aproximadamente un 79 por ciento en comparación con 2019, mientras que el total de inspecciones nacionales anuales disminuyó alrededor de un 35 por ciento".
Parte del problema es que los productos de venta libre, que incluyen gotas para los ojos, no requieren ningún tipo de revisión o inspección antes de su fabricación. Siempre que los fabricantes de productos de venta libre utilicen una “monografía” (estándares regulatorios que especifican los ingredientes activos, el etiquetado y otros requisitos generales) pueden comenzar a producir medicamentos a los pocos días de presentar su solicitud ante la FDA.
"Estos son casos muy raros, pero lo que hemos visto es que estos productos pueden causar un daño real", dijo el Dr. Timothy Janetos, oftalmólogo de la Universidad Northwestern, según AP News. "Algo necesita cambiar".
Cuando una nueva fábrica participa en la producción de productos estériles, la FDA quiere exigir a los fabricantes que avisen con al menos seis meses de antelación antes de enviar cualquier producto, dando así a los inspectores de la FDA tiempo suficiente para inspeccionar, informó AP.
No todos los productos de venta libre pueden causar el daño que pueden causar las gotas para los ojos.
"Cualquier cosa que ingieras se encontrará con el ácido del estómago, lo que matará la mayoría de las bacterias", dijo la Dra. Sandra Brown de la Dry Eye Foundation, según AP. "Es mucho más peligroso ponerse un producto en el ojo".
Parte del desafío para la FDA es reclutar y mantener un equipo de inspectores extranjeros.
"La contratación federal es intrínsecamente lenta y los salarios a menudo no son competitivos", dijo Ridley, según AP. "El Congreso debe intentar ayudar a la FDA a resolver ese problema y luego responsabilizarla de las inspecciones de personal".
En los últimos meses, la FDA ha retirado del mercado numerosas marcas de gotas para los ojos de venta libre, advirtiendo a los consumidores que no las utilicen por temor a que las gotas no esterilizadas provoquen infecciones que provoquen pérdida de visión o incluso ceguera. La última actualización de la agencia reveló que la lista de productos afectados de varias entidades había aumentado a 27, como anteriormente. reportaron by el expreso de dallas.